Il Comitato Italiano Associazioni Parkinson non promuove ne suggerisce l’uso di alcun medicinale, integratore, device né di altri prodotti ma vogliamo che tutti siano messi in grado di compiere valutazioni e scelte consapevoli e che venga garantito il diritto alle cure in modo equo in tutte le regioni della nostra nazione.
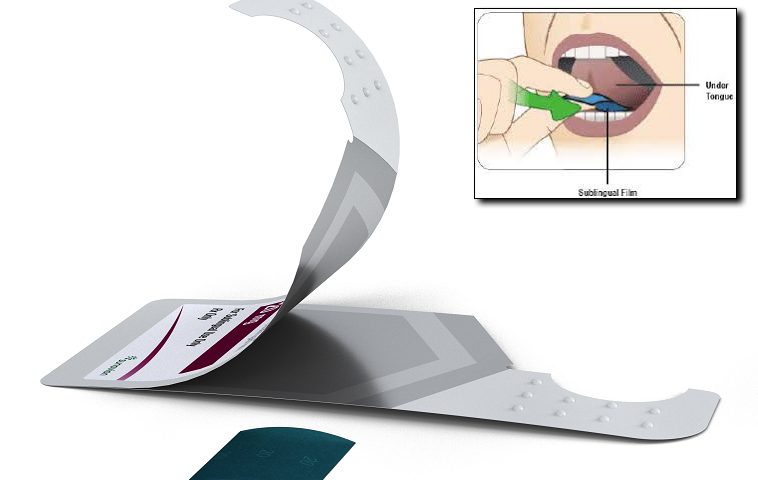
Il nuovo prodotto è basato sull’apomorfina e somministrato tramite un film sublinguale che dovrebbe consentire un rapido sollievo dalle fluttuazioni motorie nei pazienti con malattia di Parkinson, compresi gli episodi di “off” mattutini (vedi articolo del 2018).
Negli USA il farmaco è commercializzato dal 2020
Nella fase di sperimentazione il farmaco si è dimostrato efficace e generalmente sicuro, tanto che a maggio 2020 la FDA (l’equivalente dell’AIFA negli States) ne ha approvato la commercializzazione negli USA.

Incoraggianti risultati dello studio pluriennale sono stati esposti al 23° International Congress of Parkinson’s Disease and Movement Disorder Society (MSD Virtual Congress 2020). I risultati sono stati riportati anche da “Parkinson Today” ( articolo).
Riteniamo particolarmente interessante la modalità di somministrazione sublinguale che bypassa quindi la classica via digerente con tutte le problematiche che ben conosciamo.
E in Italia quando sarà disponibile il farmaco Kynmobi® ?
In Italia il farmaco sarà disponibile grazie ad un importante investimento fatto dalla azienda Bial che ben conosce la nostra realtà, dal 2018 la Bial è presente nel mercato italiano con il farmaco Ongentys® (opicapone). Campagna 2018-2019.
L’autorizzazione in Italia deve essere rilasciata da AIFA che oltre a valutare la sicurezza del farmaco ne valuta anche l’adeguatezza economica in base ai parametri imposti dal Ministero della Salute ed assegnati per tipologia di farmaco. Considerando che il “gold standard” per il Parkinson è stato commercializzato 50 anni fa è evidente che mantenendo come unico criterio il “minor costo” sarà molto difficile che un nuovo farmaco che deve ammortizzare tutti i costi di sviluppo possa arrivare nelle farmacie se non in categoria “C” (costo totalmente a carico del paziente, come per il farmaco Inbrija).
Approfondisci: Lo studio di Fase III in corso
Lascia un commento