Articolo a cura di Fulvio Capitanio
Le persone con Parkinson vorrebbero che il ritmo di scoperta e di disponibilità dei nuovi farmaci fosse abbastanza veloce in modo da poter arrivare a beneficiarsi del trattamento in vita.
Purtroppo, il numero e la frequenza di sviluppo di nuovi farmaci è sempre considerato insufficiente (non senza ragione) per coloro che vedono la loro salute che si sta deteriorando giorno dopo giorno irrimediabilmente.
Perché ci mettono così tanto i nuovi farmaci ad arrivare ai pazienti? Diamo un’occhiata alle fasi di questo processo per capire un poco meglio il passaggio dall’interesse per un composto o una molecola fino a che non diventa disponibile per il trattamento di una malattia specifica e con una posologia definita.
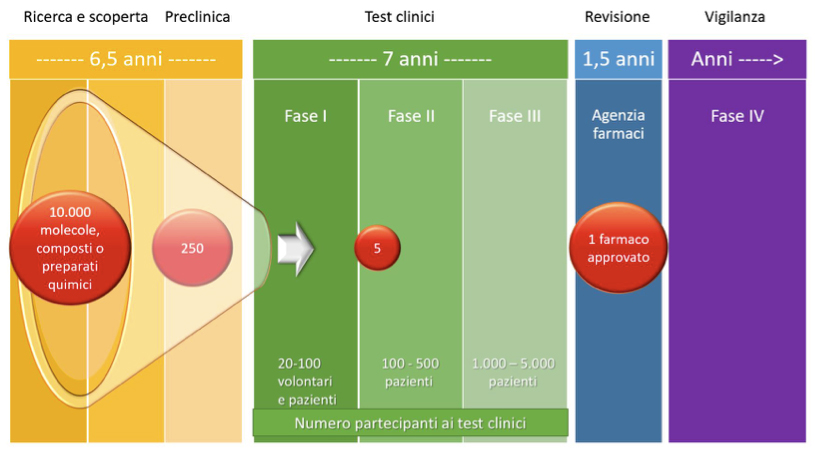
Lo sviluppo di farmaci comprende verificarne la sicurezza, l’efficacia, la formulazione e produzione. Normalmente, gli studi di sicurezza iniziano con vari esperimenti chiamati studi preclinici. Quando questi studi confermano che il candidato a farmaco è sicuro, ha inizio la valutazione negli esseri umani in una serie di studi noti come studi clinici.
Gli studi preclinici sono prove che vengono realizzate in un contesto d’uso controllato scientificamente di colture cellulari e modelli animali. Lo scopo di studi preclinici è quello di prevedere come agisce l’organismo sul farmaco in studio (farmacocinetica), come agisce il farmaco in studio sul corpo (farmacodinamica) e se il candidato a farmaco può comportare rischi potenziali per la salute o effetti collaterali tossici.
Per far sì che un nuovo farmaco o una terapia divengano di uso generale, è necessario un rigoroso iter di sperimentazione. Si tratta di esperimenti programmati, che hanno lo scopo di valutare il trattamento più appropriato di pazienti affetti da una determinata condizione.
Tale iter è rappresentato da una serie di passaggi obbligatori: ovvero gli stadi successivi che compongono la sperimentazione clinica e permettono di affrontare e risolvere incognite riguardanti la sicurezza (tossicità, tollerabilità), la posologia (dose e via di somministrazione) e, l’utilità clinica, inclusi i vantaggi rispetto ad eventuali farmaci già in commercio per le stesse indicazioni terapeutiche, del nuovo farmaco.
Si parla di studi clinici di fase I, II e III, definiti studi preregistrativi. Questi vengono utilizzati per richiedere alle autorità competenti la registrazione del nuovo farmaco, ossia l’autorizzazione alla commercializzazione ed alla prescrizione, o l’autorizzazione all’utilizzo per nuove indicazioni terapeutiche se il farmaco è già in commercio.
FASE I. Il primo passo nella sperimentazione di un nuovo farmaco è quello di determinare la sicurezza di singole dosi singole in un piccolo numero di volontari sani. Questa fase aiuta i ricercatori a capire alcuni aspetti su come funziona il farmaco in questione e si stabilisce anche il dosaggio da utilizzare successivamente.
FASE II. Se il trattamento risulta essere sicuro, iniziano studi per determinare l’efficacia del farmaco nel persone con la condizione da trattare. Questi studi possono durare diversi mesi o anni e coinvolgere un numero maggiore di persone. Lo studio potrà essere:
- a) controllato: il farmaco viene confrontato con un trattamento standard o placebo;
- b) doppio cieco: né i ricercatori né i partecipanti sanno quale trattamento sono ricezione;
- c) randomizzato: i partecipanti sono assegnati in modo casuale a ricevere un trattamento attivo o placebo
FASE III. Se un farmaco mostra efficacia, viene condotto uno studio più ampio. Questi studi clinici possono essere condotti in diversi centri (multicentrici) e in diversi Paesi, e possono durare diversi anni. Tali studi consentono ai ricercatori di valutare con maggiore precisione il potenziale del nuovo farmaco in una più ampia gamma di persone e confrontarlo con i trattamenti esistenti.
Autorizzazione EMA (European Medicines Agency). I dati di tutte le fasi precedenti e i risultati degli studi clinici vengono presentati all’autorità di regolamentazione competente. Se le autorità decidono che il nuovo farmaco è efficace, sicuro e incontra gli standard di qualità, viene rilasciata l’autorizzazione all’immissione in commercio o di licenza.
Autorizzazione AIFA (Agenzia Italiana del Farmaco). Successivamente all’autorizzazione da parte dell’EMA, l’Agenzia Italiana del farmaco opera le sue valutazioni fornendo le indicazioni specifiche per l’utilizzo di quel determinato farmaco.
Enti locali. L’iter di approvazione che porta le terapie alle persone si conclude solo quando anche le singole regioni ed in alcuni casi le singole ASL inseriscono nei loro prontuari il nuovo farmaco. In genere in questa fase viene anche attuato uno specifico piano di farmacovigilanza.
In media, ci vogliono tra i 10 ed i 15 anni per completare diverse fasi della fase di sviluppo di un farmaco. La maggior parte dei farmaci sperimentali non arrivano mai al mercato.
Articolo scritto da Fulvio Capitanio – Unidos contra el Parkinson
https://www.facebook.com/unidoscontraelparkinson